Shenzhen International Examination Medical and IVD Exhibition 2024
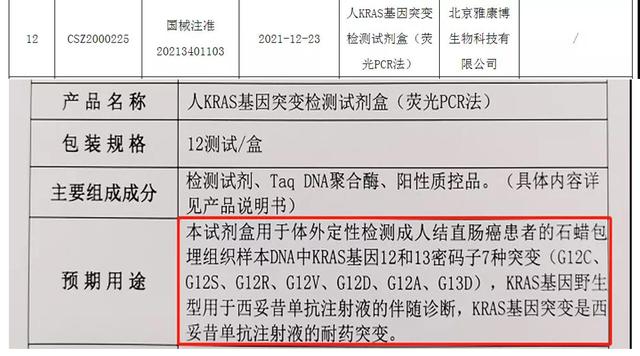
近日,由启迪控股成员企业-北京雅康博生物科技有限公司自主研发的人KRAS 基因突变检测试剂盒(荧光 PCR 法)通过国家药品监督管理局(NMPA)的审核,正式获批第三类医疗器械注册证(国械注准20213401103)。
▲ 图片来源:国家药品监督管理局官网
该试剂盒是国内首款基于PCR平台具有伴随诊断功能的KRAS基因突变检测试剂盒, 可用于体外检测成人结直肠癌患者的7种KRAS基因突变,辅助临床医生判断患者使用西妥昔单抗注射液的获益情况。

▲ 人KRAS 基因突变检测试剂盒(荧光 PCR 法)外观
KRAS是结直肠癌中常见的驱动基因,在中国结直肠癌患者中的突变率约为30~40%。临床研究表明,KRAS 基因突变与EGFR 单克隆抗体——西妥昔单抗的疗效明确相关:KRAS 野生型患者可以从西妥昔单抗治疗中获益,而 KRAS 突变型患者则会对西妥昔单抗的治疗产生耐药。目前国内外多个权威指南均指出,结直肠癌患者应进行RAS和BRAF基因检测,从而制定更有效、更具个性化的治疗方案。
近年来,雅康博生物基于实时荧光定量PCR平台,自主研发了佰康安系列产品。至此,已有EGFR、ALK、BRAF、PIK3CA、NRAS、KRAS共6款PCR试剂盒产品获NMPA批准,覆盖肺癌、结直肠癌、甲状腺癌和乳腺癌,众多产品的获批证明了雅康博生物在PCR分子诊断领域的领先地位。
值得注意的是,目前佰康安系列已有多款试剂盒被国内NGS企业采用,作为临床注册的对照产品,获得了业内的高度认可。本次获批的KRAS基因突变检测试剂盒,是雅康博生物首个以伴随诊断试剂标准获批的注册产品,延续了佰康安系列简单快速、灵敏准确、易普及等优点。今后,雅康博生物将继续秉承“以专立业、 以质取胜” 的企业理念,深耕伴随诊断产品的研发,深入拓展与国内外药企的合作,全力打造伴随诊断行业领军企业。