2024深圳国际体外诊断试剂展览会-组委会官网
Shenzhen International Examination Medical and IVD Exhibition 2024
Shenzhen International Examination Medical and IVD Exhibition 2024
深圳国际会展中心(宝安国际会展中心)
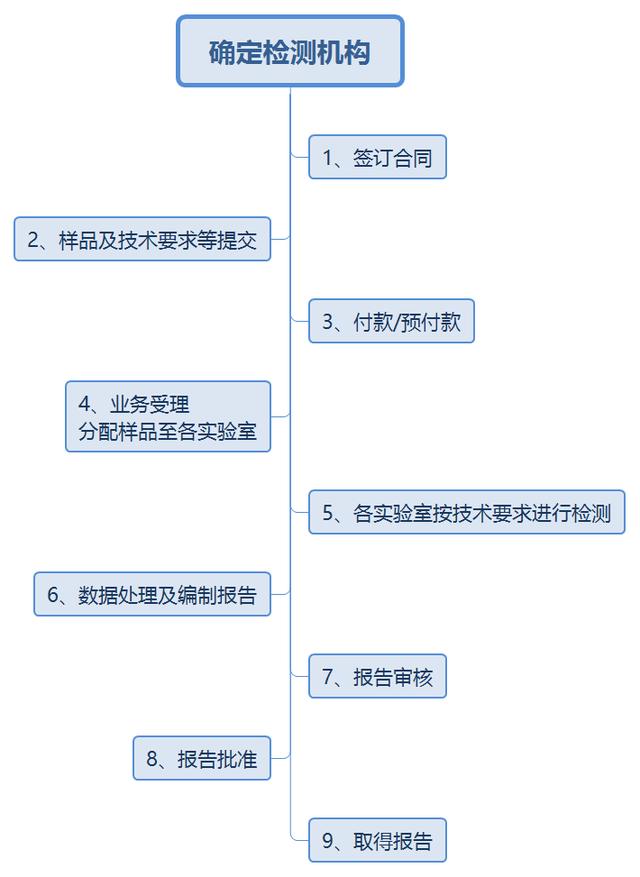
注册检验需提交的资料
1
检验申请表;
2
证明文件:申请人企业许可证(复印件),提交资料真实性的声明;
3
抽样单(抽样凭证及记录),加盖抽样单位公章;
4
综述资料;
5
产品说明书;
6
拟定申报产品技术要求;
7
主要原材料研究资料;
8
分析性能评估资料;
9
参考值(范围)确定资料;
10
稳定性研究资料;
11
标准品(参照品)及资料
12
自检报告;
13
工艺及反应体系研究资料(送检时可暂不提供,检验中如有需要,应在接到通知后10个工作日内提供);
1414
生产记录(送检时可暂不提供,检验中如有需要,应在接到通知后10个工作日内提供)。
以上资料均需加盖申请单位公章。
常见问题&解答
1
注册检测对样品数量要求
一般情况下检验用样品数量为一次检验用量的3倍。
2
样品效期要求
样品效期一般应满足2个检验周期,除特殊情况外(如进行稳定性考察),已过效期或效期内不能满足2个检验周期的样品不予受理。
3
样品规格
如果同一注册申请包括不同包装规格,可以只进行一种包装规格产品的注册检验。
4
样品状态
样品应包装完整,有说明书和完整标签,标签内容应符合国家局体外诊断试剂标签说明书相关文件规定,无正规标签的样品,必需贴有临时标签。标签内容至少包括:检品名称、批号、规格、生产单位;已确定效期的样品标签上应注明效期,有特殊储存条件要求的,标签上需注明储存条件。样品标签内容必须与资料相应内容一致。